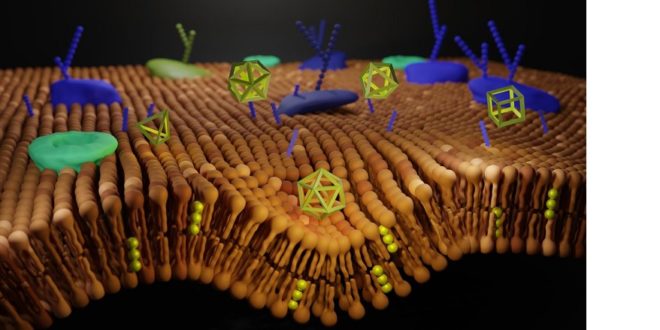
Nanostruktury uměle vytvořené z DNA mohou působit jako strukturální i funkční prvek. Nenesou v sobě genetickou informaci, ale buňkami jsou velmi dobře přijímané.
Vědci z Laboratoře biofyziky z Oddělení optických a biofyzikálních systémů přispěli do oblasti DNA nanotechnologií nedávnou systematickou analýzou. Autoři pod vedením Olega Lunova v ní shrnují současný stav znalostí o interakcích nanostruktur DNA (DN) s buňkami a identifikují klíčové výzvy z pohledu buněčné biologie, které stojí na cestě k jejich klinickému využití. Analýzu publikoval prestižní vědecký časopis Acta Biomaterialia. Práce vznikala v rámci pokračující spolupráce s týmem prof. Nicholase Stephanopoulose z Arizona State University.
Autoři již dříve odhalili, jak proteinový obal ovlivňuje fungování DN uvnitř buněk. V rámci svého nejnovějšího článku se krom studia proteinového obalu zaměřili také na analýzu interakce DN ligandů s proteiny buněčného povrchu. Přesněji to, jakým způsobem dochází k jejich vazbě na okolní buňky, cytotoxicitu a interakci DN s živými buňkami.
„DNA nanostruktury mají velký biomedicínský potenciál. Očekáváme, že v blízké budoucnosti s nimi uvidíme řadu aplikací přenesených do klinického použití. Pro klinický úspěch DNA nanostruktur je ovšem zásadní pochopení výzev a omezení jejich terapeutické aplikace. Tato naše kritická analýza pomůže výzkumníkům vytvořit plán pro jejich překonání,“ řekl vedoucí výzkumného týmu Oleg Lunov.
Nejnovější přehled vypracovaný týmem z Laboratoře biofyziky identifikuje některé výzvy v oblasti DN, včetně jejich stability za fyziologických podmínek či důležitosti výběru buněčného modelu, čili typu a linie buněk využitých v rámci výzkumu. Dále poukazuje na nutnost sjednocení pravidel při přípravě DN, jejich charakterizaci a pokusech s nimi i na potřebu využití modelů in vivo, které přinášejí relevantnější výsledky v případě jejich budoucího využití v humánní medicíně. Hovoří i o sekvestraci jater (oddělování odumřelé části tkáně od živé). Právě játra jsou specificky zmiňována proto, že drtivá většina nanomateriálů se odbourává právě v nich.
„Zapojení jednoho z našich týmů do špičkového interdisciplinárního výzkumu ve spolupráci s prestižním americkým pracovištěm považuji za vynikající úspěch. Ukazuje se, že mezioborovost, na kterou jsme na sekci optiky vsadili, se vyplácí a náš výzkum dostává na světovou úroveň. Propojení fyziky, chemie a biologie má potenciál v budoucnosti změnit pohled na vědu a v mnohém vylepšit naše každodenní životy,“ říká Alexandr Dejneka, vedoucí Sekce optiky, do které Laboratoř biofyziky patří.
Nanostruktury uměle vytvořené z DNA mohou působit jako strukturální i funkční prvek. Protože jde v podstatě jen o model obalu samotné DNA, nenesou v sobě genetickou informaci, ale buňkami jsou velmi dobře přijímané. Představují jedinečný kompozitní materiál s různými aplikacemi v biomedicíně a slibují překonat přetrvávající výzvy v oblasti nanobiotechnologií. Široké využití mohou najít například v oblasti cíleného doručování léčiv, nebo v aplikacích jako je biosensing, buněčná modulace či bioimaging. Interakce mezi uměle vytvořenými DN a živými buňkami ještě nejsou dostatečně prozkoumány a popsány. I k tomu by měla napomoci tato analýza.

Překlápění fosfolipidu na plazmatické membráně je známkou programované buněčné smrti. V tomto případě ji způsobily léky uvolněné z DNA nanostruktury pohlcené buňkou.
 Sciencemag.cz
Sciencemag.cz